RESUMO
OBJETIVO: Estudos recentes de fluxo com modelos experimentais de anastomoses cavopulmonares totais (ACPTs) baseados em ressonância magnética e angiografia demonstram que este é um procedimento bem estabelecido para o tratamento de várias cardiopatias, mas o melhor arranjo espacial continua controverso. Nosso intuito é apresentar os resultados imediatos com três diferentes técnicas de ACPTs. MÉTODOS: Ensaio clínico de ACPTs realizadas no período de janeiro de 2005 a julho de 2008 com 40 pacientes, com idade média de 6,4 ± 3,2 anos, com Glenn prévio. Os pacientes foram divididos em três grupos, dependendo da técnica cirúrgica empregada: Grupo 1 (G1) - túnel lateral; Grupo 2 (G2) - conduto extracardíaco; Grupo 3 (G3) - conduto intracardíaco dirigido para o ramo esquerdo de artéria pulmonar, todos com fenestração. Foram avaliadas variáveis pré e pós-operatórias. RESULTADOS: Foram incluídos 11 pacientes no G1, 10 no G2 e 19 no G3. As variáveis pré-operatórias foram semelhantes nos três grupos (P>0,05). A mortalidade foi maior nos Grupos 1 e 2 (9,1% e 10,0%, respectivamente), comparadas ao Grupo 3 (zero), porém sem significância estatística (P=0,3841). Efusão pleural foi ausente no Grupo 3, diferença significativa (P=0,0128) em relação aos outros grupos (40,0% e 33,3%). A mediana do tempo de hospitalização pós-operatória foi menor no Grupo 3 (8 dias), em relação aos grupos 1 e 2 (18 e 13 dias, respectivamente) (P=0,0164). CONCLUSÃO: A técnica de conduto intracardíaco foi associada a menor morbidade pós-operatória, sendo a opção atual do nosso serviço na anastomose cavopulmonar total.
ABSTRACT
OBJECTIVES: Recent experimental flow studies based on angiography and magnetic resonance have shown that total cavopulmonary anastomosis (TCPA) is a valid concept for surgical treatment of many congenital heart defects, but there is not agreement of the best surgical arrangement. Our purpose is to analyze the immediate results with three different techniques of TCPA. METHODS: We sought to analyze retrospectively all TCPA realized from January 2005 to July 2008; there were 40 patients, all with previous Glenn anastomosis, with mean age of 6.4 ± 3.2 years. Three different techniques were employed: Group 1 (G1) lateral tunnel, Group 2 (G2) extracardiac conduits, Group 3 (G3) intracardiac conduit directed to the left pulmonary artery. All patients had a fenestration done. RESULTS: G1 had 11 patients, G2 10 patients and G3 19 patients. Preoperative data were similar in the 3 groups (P>0.05). Surgical mortality was higher in Groups 1 and 2 (9.1% and 10%) compared to Group 3 (0%) but there was no statistical significance (P=0.3841). Pleural effusion was absent in Group 3 (0%), which was statistically significant in relation to the other groups (P=0.0128). The hospitalization time was also significantly lower in G3 (8 days) in relation to G1 (18 days) and G2 (13 days) (P=0.0164). CONCLUSION: Intracardiac TCPA was associated with lower postoperative morbidity and is currently our preferred technique.
INTRODUÇÃO
Desde a publicação da técnica original de derivação átrio-pulmonar por Francis Fontan, em 1971 [1], uma série de técnicas cirúrgicas foi desenvolvida para o tratamento das cardiopatias univentriculares [2-5]. Porém, os estudos hidrodinâmicos realizados por de Leval et al. [5], em 1988, demonstraram que a presença do átrio direito produzia perda cinética considerável no sistema e assim lançaram o conceito de anastomose cavopulmonar total. O procedimento por eles proposto, posteriormente nominado de túnel lateral, que consistia na criação de um túnel entre os orifícios da veia cava inferior e superior com uma calha de prótese suturada no aspecto lateral do átrio direito, proporcionava um fluxo mais laminar ao sistema, mas não redundou em uma significativa redução na incidência de complicações, em especial das arritmias atriais e das disfunções do nó sinusal [6,7].
Em 1990, Marceletti et al. [8] apresentaram uma nova técnica de anastomose cavopulmonar total, que consistia na interposição de conduto protético entre a veia cava inferior e a face inferior do ramo direito de artéria pulmonar externamente ao coração. O fundamento desse procedimento era o de manter o átrio direito como câmara de baixa pressão e livre de suturas potencialmente arritmogênicas [9].
As técnicas de anastomose cavopulmonar têm dominado o cenário de tratamento das cardiopatias univentriculares desde então, sendo que as duas técnicas são frequentemente utilizadas numa mesma instituição [10]. No entanto, as efusões pleurais continuam a ser uma importante fonte de morbidade no período pós-operatório imediato, com incidência variando na literatura de 13% a 39% [11]. Na nossa instituição, as duas técnicas foram concomitantemente utilizadas até 2006, quando, devido à alta incidência de complicações pleurais, desenvolvemos uma variante técnica de anastomose cavopulmonar total.
Estudos de fluxo com modelos fantasmas construídos em vidro soprado baseados em imagens de ressonância magnética e angiografia realizados por Amodeo et al. [12] demonstraram que o fluxo da veia cava inferior dirigido para o ramo esquerdo da artéria cria efeito de vortex, que ajuda na distribuição de fluxo entre os ramos pulmonares e provê um padrão mais favorável de economia de energia.
Baseados nessas observações, passamos a utilizar técnica cirúrgica na qual conduto de politetrafluoroetileno (PTFE) é interposto entre a veia cava inferior e artéria pulmonar, cursando pelo interior do átrio direito, através do forame oval em direção ao teto do átrio esquerdo, por onde é exteriorizado e anastomosado ao tronco ou ramo esquerdo de artéria pulmonar. Essa técnica permitiu atingir o ramo esquerdo de artéria pulmonar com uma prótese de menor tamanho, com menos curvas e ângulos, minimizando assim a presença de material inflexível no sistema.
O objetivo do presente trabalho foi rever os resultados imediatos dos pacientes submetidos à cirurgia de Fontan em uma única instituição com três modelos de anastomose cavopulmonar total.
MÉTODOS
Desenho do estudo
Foi realizado ensaio clínico de 40 pacientes com fisiologia univentricular submetidos à cirurgia de Fontan no Biocor Instituto, de janeiro de 2005 a julho de 2008. Os dados relativos aos períodos pré, per e pós-operatório foram obtidos pela revisão dos prontuários eletrônicos dos pacientes identificados no sistema implantado pela instituição em janeiro de 2005. Os diagnósticos são mostrados na Tabela 1. Esse estudo foi aprovado pelo comitê de ética do hospital.
Técnica operatória
Todos os pacientes estudados foram previamente submetidos à cirurgia de anastomose cavopulmonar bidirecional (procedimento de Glenn), com ou sem a manutenção de fluxo acessório, conforme previamente publicado [13,14], sendo que em quatro deles complementou-se esse estágio com um procedimento de Hemifontan.
Até outubro de 2006, eram realizadas as técnicas de túnel lateral e conduto externo, dependendo da opção do cirurgião. Em todos os casos foi utilizada circulação extracorpórea (CEC), normotérmica e sem pinçamento aórtico nos casos de conduto externo, e levemente hipotérmica e com cardioplegia cristalóide no túnel lateral.
Na técnica de túnel lateral, a área correspondente ao coto proximal da veia cava superior era anastomosada à face inferior do ramo direito da artéria pulmonar. Após atriotomia direita, remendo de pericárdio bovino era suturado ao redor do orifício interno da veia cava inferior e continuava superiormente à frente das veias pulmonares direitas contornando o orifício interno da veia cava superior. Uma fenestração de 4 mm era criada diretamente no remendo implantado, seguida de atriorrafia direita. Esses pacientes constituíram o Grupo 1.
Para o conduto externo, foi utilizada prótese de Dacron de 18 a 24 mm, interposta entre a veia cava inferior e a face inferior do ramo direito de artéria pulmonar. A veia cava inferior era transseccionada ao nível da junção cavoatrial e anastomosada ao conduto, que passava ao lado do átrio direito até alcançar a artéria pulmonar. O coto proximal da veia cava inferior era fechado com sutura direta. Na face do conduto em contato com o átrio direito era criada fenestração de 4 mm. Parte da parede do átrio direito era excluída com pinçamento lateral, onde se fazia pequena atriotomia, suturada ao redor da fenestração. Esses pacientes foram incluídos no Grupo 2.
O Grupo 3 constituiu-se de todos os pacientes operados a partir de outubro de 2006, quando a técnica descrita a seguir foi adotada como primeira opção no serviço. Foi utilizada circulação extracorpórea com hipotermia leve e cardioplegia sanguínea isotérmica. Após pinçamento da aorta era realizada atriotomia direita convencional. A lâmina da fossa oval, assim como todo o septo interatrial ressecável, era retirada, criando uma ampla comunicação interatrial. Pequeno segmento com 4 a 5 cm de conduto de PTFE de 18 a 22 mm era suturado ao redor do orifício interno da veia cava inferior e passado através do septo interatrial para o interior do átrio esquerdo. Era realizada ampla arteriotomia pulmonar a partir do segmento mais proximal do ramo direito da artéria pulmonar, com extensão para a face direita do tronco de artéria pulmonar, evitando a todo custo convergência com o fluxo do Glenn. Sempre que necessário, o tronco de artéria pulmonar era dissecado e transseccionado ao nível da bifurcação, sendo o orifício distal utilizado como a arteriotomia pulmonar em questão.
O conduto era exteriorizado e ajustado através de pequena atriotomia feita no teto do átrio esquerdo. Era então confeccionada sutura contínua contendo as paredes arterial pulmonar, atrial e o conduto. Fenestração de 4 mm foi feita diretamente no conduto implantado em todos os casos, após o que o átrio direito era fechado e a pinça de aorta retirada (Figura 1).
Variáveis estudadas
As seguintes variáveis foram coletadas e comparadas entre os três grupos: idade, peso, sexo, afecção, dominância ventricular, procedimentos cirúrgicos ou intervencionistas prévios, pressão arterial média obtida do último cateterismo cardíaco realizado, a saturação arterial medida por saturímetro digital na véspera da cirurgia, evidência de fluxo pulmonar acessório pelo cateterismo cardíaco ou ecocardiograma e a presença de Glenn bicaval. Como variáveis cirúrgicas foram anotadas a técnica utilizada e o tempo de CEC. O tempo de pinçamento aórtico não foi coletado, pois os casos de conduto externo foram realizados sem parada cardíaca. Do pós-operatório obteve-se a pressão arterial pulmonar média inferida pela pressão venosa central medida no cateter rotineiramente colocado na veia jugular interna de todos os pacientes, imediatamente após a chegada ao centro de tratamento intensivo pediátrico (CETIPE) e com a cabeceira inclinada a 30 graus, a saturação de oxigênio obtida do último exame laboratorial gasométrico realizado no CETIPE, a presença de infecção no pós-operatório, o tempo de permanência no CETIPE e de hospitalização pós-operatória, a necessidade de reoperações e a ocorrência de complicações e/ou mortalidade.
Importante ressaltar que o regime terapêutico de vasodilatação pulmonar no pós-operatório foi constante ao longo de todo o estudo, com infusão rotineira de milrinone em todos os casos e administração de sildenafil em pacientes com pressão arterial pulmonar aumentada e saturação periférica baixa.
Efusão pleural foi definida como a presença de drenagem pleural por mais de 2 semanas, ou drenagem superior a 20 ml/kg de peso/dia por mais de 48 horas, ou a necessidade de toracocentese de repetição ou ainda a necessidade de pleurodese química ou cirúrgica. Não foi feita distinção entre os derrames quilosos ou não quilosos. Os critérios de efusão pleural persistente foram estabelecidos após revisão da literatura [11,15] e com base nas observações clínicas do serviço.
Análise estatística
A hipótese testada foi a de que a incidência de complicações precoces seria menor com a modificação técnica da cirurgia de anastomose cavopulmonar total por nós desenvolvida, quando comparada às técnicas clássicas de túnel lateral e conduto externo, em um grupo homogêneo de pacientes operados numa mesma instituição, em tempo relativamente curto e com as mesmas condições cirúrgicas e de pós-operatório. Os dados foram submetidos à análise estatística no programa EpiInfo. (versão 6.04b, Epidemiology Programm Office, Centers for Disease Control, Atlanta, Estados Unidos) e são apresentados como a média mais ou menos um desvio padrão. O teste do qui quadrado, com a utilização da correção de Yates, foi usado para comparar as diferenças entre variáveis discretas. O teste exato de Fisher foi utilizado nos casos de pequenas amostras em cada categoria, quando o valor esperado foi inferior a cinco. O teste t de Student foi usado para comparar diferenças entre variáveis contínuas com distribuição guassiana e o teste do Kruskal Wallis quando estas variáveis não apresentaram a mesma distribuição. O valor de P menor ou igual a 0,05 foi considerado estatisticamente significante.
RESULTADOS
No período compreendido entre janeiro de 2005 e julho de 2008, 40 pacientes foram submetidos à anastomose cavopulmonar total na nossa instituição, sendo que em 11 (27,5%) a técnica utilizada foi a do túnel lateral, em 10 (25%) a do conduto externo e em 19 (47,5%) a do conduto interno. Nenhum paciente necessitou de "
take-down" no pós-operatório imediato, devido à falha hemodinâmica do circuito cavopulmonar implantado.
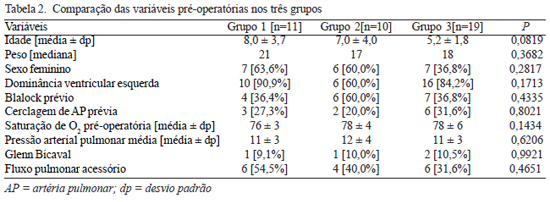
A Tabela 2 mostra os dados demográficos e as variáveis pré-operatórias comparativamente entre os três grupos. Os pacientes dos Grupos 1 e 2 apresentavam idade ligeiramente superior quando comparadas ao Grupo 3, embora este dado não tenha alcançado relevância estatística (8,0 ± 3,7 anos e 7,0 ± 4,0 anos versus 5,2 ± 1,8 anos). As demais variáveis coletadas foram homogêneas entre os três grupos.
Quanto às variáveis per e pós-operatórias (Tabela 3), o tempo de CEC foi semelhante nos três grupos, o que demonstra que a nova técnica é comparável em termos de complexidade às técnicas clássicas. Os três grupos demonstraram semelhança também quanto ao desempenho hemodinâmico e incidência de infecções. Porém, a ocorrência de efusão pleural persistente, muito prevalente nos Grupos 1 (40%) e 2 (33%), não foi observada no Grupo 3 (P = 0,0128). Consequência direta da efusão pleural foi a necessidade de manutenção dos drenos torácicos por mais tempo, o que refletiu de forma significativa no tempo de hospitalização (P = 0,0164).

A mortalidade hospitalar de todo o grupo foi de 5%. Ocorreu um óbito no Grupo 1 e outro no Grupo 2, sendo que no grupo conduto interno não houve ocorrência de mortalidade. O resultado, no entanto, não alcançou significância estatística.
DISCUSSÃO
A cirurgia de Fontan tem sido a técnica cirúrgica que mais tem se modificado dentro da cirurgia cardíaca pediátrica. Atualmente, está bem estabelecida a superioridade da anastomose cavopulmonar sobre a anastomose atriopulmonar [16-18], porém a discussão prossegue quanto à melhor técnica de anastomose cavopulmonar total: túnel lateral ou conduto externo [19-22]. Modelos computacionais de dinâmica de fluidos dos efeitos do exercício na hemodinâmica das duas técnicas recentemente desenvolvidos têm demonstrado superioridade do conduto externo quando comparado ao túnel lateral [23]. Por esse motivo, a grande maioria das técnicas apresentadas ultimamente na literatura é baseada no conceito de conduto externo [24-28].
Em recente artigo, Bove et al. [29], trabalhando em modelos computacionais avançados, analisaram os princípios da busca pela hemodinâmica ideal no Fontan: menor dissipação de energia por meio de anastomoses sem ângulos agudos, estenoses ou dilatações, menor presença possível de material rígido, fixo e impermeável e distribuição de fluxo pulmonar homogênea. Outro trabalho clássico, realizado por Amodeo et al. [12], demonstrou que a orientação do fluxo da veia cava inferior para o ramo esquerdo de artéria pulmonar cria efeito de vórtex na artéria pulmonar, que regula a distribuição do sangue entre os ramos pulmonares e promove um padrão de economia de energia mais favorável se comparada à situação em que as anastomoses das veias cavas superior e inferior estão em oposição. Baseados nesses princípios, desenvolvemos a técnica do conduto interno dirigindo a veia cava inferior para o teto do átrio esquerdo, o que permite respeitar grande parte dessas premissas. O trajeto do conduto é o mais retilíneo dentre as técnicas vigentes. O uso de material protético, ou seja, não pulsátil, fixo e não permeável, é minimizado, já que as próteses não ultrapassam 5 a 6 cm. A prótese é facilmente fenestrável e é dirigida diretamente para o ramo esquerdo de artéria pulmonar. Além disso, o arranjo intra-atrial alcançado com a ressecção do septo interatrial permitiu o implante de próteses de pelo menos 18 mm de diâmetro, até mesmo em crianças com 3 anos de vida. Isto é consistente com o protocolo estabelecido por Kirklin et al. [30] e teve impacto direto no resultado de longo prazo, com uma incidência muito baixa de reoperações para revisão ou troca de conduto em até 16 anos de seguimento.
Stamm et al. [31] descreveram técnica similar em pacientes com síndrome heterotáxica, porém dirigiam o conduto intra-atrial para o orifício da veia cava superior ou para o teto do átrio direito, arranjo bastante semelhante à técnica do túnel lateral. Na nossa casuística, apenas quatro pacientes eram portadores dessa síndrome, sendo um paciente nos Grupos 1 e 3 e dois pacientes no Grupo 2. A maioria dos pacientes tinha, portanto, anatomia intra-atrial usual. A vantagem de se dirigir o conduto para o teto do átrio esquerdo passando pelo septo interatrial é o alinhamento que se obtém entre a veia cava inferior, o conduto e o ramo esquerdo de artéria pulmonar.
Diversos tipos de material têm sido utilizados na confecção da derivação entre a veia cava inferior e a artéria pulmonar [32-34]. Nos casos de conduto externo da presente experiência, foram utilizados tubos de Dacron tratados com colágeno bovino. Porém, a observação de alguns casos de trombose tardia do tubo observada na nossa experiência (não foram objetivo do presente trabalho) e de outros autores [35], levou-nos a optar pelo politetrafluoroetileno (PTFE) como o conduto de escolha. Este material tem sido extensamente utilizado no interior das câmaras cardíacas, tanto como remendo quanto como conduto, com excelente resultado e baixa incidência de complicações tromboembólicas, mesmo em regime terapêutico com uso exclusivo de aspirina [30].
O ponto mais expressivo do presente trabalho foi a baixa incidência de efusões pleurais encontrada na técnica de conduto interno que contribuiu diretamente na redução da morbidade e da permanência hospitalar. A longo prazo, está bem estabelecido que a efusão pleural se correlaciona com a incidência de síndrome perdedora de proteína e diminui a sobrevivência [17]. Os mecanismos que contribuem para o desenvolvimento da efusão pleural incluem fatores hormonais, hidrostáticos e inflamatórios. Os mecanismos hormonais envolvem a ativação do sistema renina-angiotensina, com envolvimento do peptídeo natridiurético e da vasopressina [11].
É sabido que a circulação extracorpórea (CEC) causa reação inflamatória, que resulta em extravasamento capilar e retenção de líquidos. Shikata et al. [36], estudando dois grupos de pacientes operados com e sem CEC, notaram significativa redução na incidência de efusão no grupo sem CEC. Gupta et al. [11] consideraram o tempo de CEC prolongado como fator de risco independente para volume de drenagem pleural excessiva. Na presente série, a CEC foi utilizada em todos os casos e o tempo foi semelhante nos três grupos, não tendo sido, portanto, determinante no resultado obtido. Se, no entanto, a CEC tem efeito pró-inflamatório, por outro lado a cirurgia sem CEC obriga o cirurgião a deslocar a anastomose na artéria pulmonar em direção do ramo esquerdo em função da presença do Glenn, criando naturalmente condições hidrodinâmicas mais favoráveis. A presença de infecção no pós-operatório [11] e até mesmo a realização da cirurgia na estação viral [15] têm sido consideradas como fatores de risco para a ocorrência de efusão pleural.
Parecem ser, no entanto, os fatores hemodinâmicos e hidrodinâmicos os principais responsáveis pelos resultados imediatos e tardios da cirurgia de Fontan. Pressão venosa central elevada, ausência de fenestração, circulação colateral aortopulmonar significante [15], complacência vascular pulmonar [37], saturação arterial pré-operatória baixa e tamanho pequeno do conduto [11]. Várias dessas variáveis foram testadas no presente trabalho, mas foram semelhantes entre os três grupos. Imputamos, assim, os bons resultados encontrados ao bom desempenho hidrodinâmico da técnica de conduto interno.
CONCLUSÃO
Os resultados imediatos obtidos com a anastomose cavopulmonar total pela técnica do conduto intracardíaco foram superiores quando comparada às técnicas clássicas de túnel lateral e conduto externo. A menor morbidade pós-operatória expressa pela ocorrência de efusão pleural, com consequente diminuição do tempo de internação hospitalar, faz da técnica de conduto interno a opção atual do nosso serviço na anastomose cavopulmonar total. No entanto, os resultados tardios deverão ser apurados, para que essa preferência seja efetivamente validada.
REFERÊNCIAS
1. Fontan F, Baudet E. Surgical repair of tricuspid atresia. Thorax. 1971;26(3):240-8. [MedLine]
2. Kreutzer G, Galindez E, Bono H, De Palma C, Laura JP. An operation for the correction of tricuspid atresia. J Thorac Cardiovasc Surg. 1973;66(4):613-21. [MedLine]
3. Björk VO, Olin CL, Bjarke BB, Thorén CA. Right atrial-right ventricular anastomosis for correction of tricuspid atresia. J Thorac Cardiovasc Surg. 1979;77(3):452-8. [MedLine]
4. Yacoub M, Ahmed M, Radley-Smith R. Proceedings: Use of right atrium to pulmonary artery valved conduit for 'correction' of single ventricle of hypoplastic right heart syndrome. Br Heart J. 1975;37(7):782. [MedLine]
5. de Leval MR, Kilner P, Gewillig M, Bull C. Total cavopulmonary connection: a logical alternative to atriopulmonary connection for complex Fontan operations. Experimental studies and early clinical experience. J Thorac Cardiovasc Surg. 1988;96(5):682-95. [MedLine]
6. Manning PB, Mayer JE Jr, Wernovsky G, Fishberger SB, Walsh EP. Staged operation to Fontan increases the incidence of sinoatrial node dysfunction. J Thorac Cardiovasc Surg. 1996;111(4):833-9.
7. Durongpisitkul K, Porter CJ, Cetta F, Offord KP, Slezak JM, Puga FJ, et al. Predictors of early-and late-onset supraventricular tachyarrhythmias after Fontan operation. Circulation. 1998;98(11):1099-107. [MedLine]
8. Marcelletti C, Corno A, Giannico S, Marino B. Inferior vena cava-pulmonary artery extracardiac conduit: a new form of right heart bypass. J Thorac Cardiovasc Surg. 1990;100(2):228-32. [MedLine]
9. Bromberg BI, Schuessler RB, Gandhi SK, Rodefeld MD, Boineau JP, Huddleston CB. A canine model of atrial flutter following the intra-atrial lateral tunnel Fontan operation. J Electrocardiol. 1998;30(Suppl):85-93. [MedLine]
10. Kumar SP, Rubinstein CS, Simsic JM, Taylor AB, Saul JP, Bradley SM. Lateral tunnel versus extracardiac conduit Fontan procedure: a concurrent comparison. Ann Thorac Surg. 2003;76(5):1389-96.
11. Gupta A, Daggett C, Behera S, Ferraro M, Wells W, Starnes V. Risk factors for persistent pleural effusions after the extracardiac Fontan procedure. J Thorac Cardiovasc Surg. 2004;127(6):1664-9. [MedLine]
12. Amodeo A, Grigioni M, Oppido G, Daniele C, D'Avenio G, Pedrizzetti G, et al. The beneficial vortex and best spatial arrangement in total extracardiac cavopulmonary connection. J Thorac Cardiovasc Surg. 2002;124(3):471-8. [MedLine]
13. Fantini FA, Gontijo Filho B, Martins C, Lopes RM, Heiden E, Vrandecic E, et al. Cirurgia de Glenn bidirecional: importância da manutenção de fluxo "pulsátil" na artéria pulmonar. Rev Bras Cir Cardiovasc. 1995;10(1):25-33. Visualizar artigo
14. Gontijo Filho B, Fantini FA, Lopes RM, Martins C, Castro MF, Drumond LF, et al. Resultados a médio prazo da anastomose de Glenn bidirecional. Rev Bras Cir Cardiovasc. 1999;14(1):39-45. Visualizar artigo
15. Fedderly RT, Whitstone BN, Frisbee SJ, Tweddell JS, Litwin SB. Factors related to pleural effusions after Fontan procedure in the era of fenestration. Circulation. 2001;104(12 Suppl 1):I148-I-51.
16. d'Udekem Y, Iyengar AJ, Cochrane AD, Grigg LE, Ramsay JM, Wheaton GR, et al. The Fontan procedure: contemporary techniques have improved long-term outcomes. Circulation. 2007;116(11 Suppl):I157-64. [MedLine]
17. Hirsch JC, Goldberg C, Bove EL, Salehian S, Lee T, Ohye RG, et al. Fontan operation in the current era: a 15-year single institution experience. Ann Surg. 2008;248(3):402-10. [MedLine]
18. Giardini A, Napoleone CP, Specchia S, Donti A, Formigari R, Oppido G, et al. Conversion of atriopulmonary Fontan to extracardiac total cavopulmonary connection improves cardiopulmonary function. Int J Cardiol. 2006;113(3):341-4. [MedLine]
19. Kim SJ, Kim WH, Lim HG, Lee JY. Outcome of 200 patients after an extracardiac Fontan procedure. J Thorac Cardiovasc Surg. 2008;136(1):108-16. [MedLine]
20. Giannico S, Hammad F, Amodeo A, Michielon G, Drago F, Turchetta A, et al. Clinical outcome of 193 extracardiac Fontan patients: the first 15 years. J Am Coll Cardiol. 2006;47(10):2065-73. [MedLine]
21. Azakie A, McCrindle BW, Van Arsdell G, Benson LN, Coles J, Hamilton R, et al. Extracardiac conduit versus lateral tunnel cavopulmonary connections at a single institution: impact on outcomes. J Thorac Cardiovasc Surg. 2001;122(6):1219-28. [MedLine]
22. Fiore AC, Turrentine M, Rodefeld M, Vijay P, Schwartz TL, Virgo KS, et al. Fontan operation: a comparison of lateral tunnel with extracardiac conduit. Ann Thorac Surg. 2007;83(2):622-9.
23. Whitehead KK, Pekkan K, Kitajima HD, Paridon SM, Yoganathan AP, Fogel MA. Nonlinear power loss during exercise in single-ventricle patients after the Fontan: insights from computational fluid dynamics. Circulation. 2007;116(11 Suppl):I165-71. [MedLine]
24. McKay R, Dearani JA. Extracardiac Fontan with direct cavopulmonary connections. Ann Thorac Surg. 2008;85(2):669-71. [MedLine]
25. Park HK, Youn YN, Yang HS, Yoo BW, Choi JY, Park YH. Results of an extracardiac pericardial-flap lateral tunnel Fontan operation. Eur J Cardiothorac Surg. 2008;34(3):563-8.
26. Croti UA, Braile DM, Godoy MF, Avona FN. Alternativa para operação tipo Fontan extracardíaco: anastomose direta entre o tronco pulmonar e a veia cava inferior. Rev Bras Cir Cardiovasc. 2008;23(3):439-41. [MedLine] Visualizar artigo
27. Baslaim G. Bovine valved xenograft (Contegra) conduit in the extracardiac Fontan procedure: the preliminary experience. J Card Surg. 2008;23(2):146-9. [MedLine]
28. Soerensen DD, Pekkan K, de Zélicourt D, Sharma S, Kanter K, Fogel M, et al. Introduction of a new optimized total cavopulmonary connection. Ann Thorac Surg. 2007;83(6):2182-90. [MedLine]
29. Bove EL, de Leval MR, Migliavacca F, Balossino R, Dubini G. Toward optimal hemodynamics: computer modeling of the Fontan circuit. Pediatr Cardiol. 2007;28(6):477-81. [MedLine]
30. Kirklin JK, Brown RN, Bryant AS, Naftel DC, Colvin EV, Pearce FB, et al. Is the "perfect Fontan" operation routinely achievable in the modern era? Cardiol Young. 2008;18(3):328-36. [MedLine]
31. Stamm C, Friehs I, Duebener LF, Zurakowski D, Mayer JE Jr, Jonas RA, et al. Improving results of the modified Fontan operation in patients with heterotaxy syndrome. Ann Thorac Surg. 2002;74(6):1967-77.
32. Tokunaga S, Kado H, Imoto Y, Masuda M, Shiokawa Y, Fukae K, et al. Total cavopulmonary connection with an extracardiac conduit experience with 100 patients. Ann Thorac Surg. 2002;73(1):76-80. [MedLine]
33. Croti UA, Braile DM, Moscardini AC, Godoy MF. Cavopulmonar total extracardíaco com tubo de pericárdio bovino corrugado sem auxílio de circulação extracorpórea. Rev Bras Cir Cardiovasc. 2005;20(3):346-7. Visualizar artigo
34. Lemler MS, Ramaciotti C, Stromberg D, Scott WA, Leonard SR. The extracardiac lateral tunnel Fontan, constructed with bovine pericardium: comparison with the extracardiac conduit Fontan. Am Heart J. 2006;151(4):928-33. [MedLine]
35. Paulista PP, Souza LCB, Chaccur P, Issa M, Almeida AFS, Guerra ALP, et al. Conduto extracardíaco na derivação cavopulmonar total. Rev Bras Cir Cardiovasc. 2003;18(3):203-9. Visualizar artigo
36. Shikata F, Yagihara T, Kagisaki K, Hagino I, Shiraishi S, Kobayashi J. Does the off-pump Fontan procedure ameliorate the volume and duration of pleural and peritoneal effusions? Eur J Cardiothorac Surg. 2008;34(3):570-5.
37. Yun TJ, Im YM, Jung SH, Jhang WK, Park JJ, Seo DM, et al. Pulmonary vascular compliance and pleural effusion duration after the Fontan procedure. Int J Cardiol. 2009;133(1):55-61. [MedLine]
Article receive on segunda-feira, 13 de abril de 2009



 All scientific articles published at www.bjcvs.org are licensed under a Creative Commons license
All scientific articles published at www.bjcvs.org are licensed under a Creative Commons license