Carolina Pelzer SussenbachI; João Carlos GuaragnaII; Rômulo Soares CastagninoI; Jaqueline PiccoliIII; Luciano Cabral AlbuquerqueII; Marco Antônio GoldaniI; João Batista PetraccoI; Luiz Carlos BodaneseII
DOI: 10.5935/1678-9741.20130060
RESUMO
INTRODUÇÃO: A cirurgia de revascularização do miocárdio muitas vezes é o tratamento de escolha de pacientes que sofrem angina instável. Não sabemos se essa condição acresce morbimortalidade nesse cenário.
OBJETIVO: Comparar os desfechos dos pacientes submetidos a cirurgia de revascularização do miocárdio com quadro de angina instável com os pacientes submetidos a cirurgia de revascularização do miocárdio que não apresentaram angina instável.
MÉTODOS: Coorte retrospectiva. A angina instável foi definida como síndrome coronariana aguda sem supradesnivelamento de ST e sem alteração enzimática e/ou angina classe IV.
RESULTADOS: No período entre fevereiro de 1996 a julho de 2010, de 2.818 a cirurgia de revascularização do miocárdio isoladas realizadas, 1.016 (36,1%) pacientes apresentaram angina instável. A análise multivariada demonstrou que os pacientes com angina instável no pré-operatório utilizaram mais medicações como ácido acetilsalicílico, betabloqueador, heparina (anticoagulação plena), nitrato e menor necessidade de diureticoterapia, do que pacientes sem angina instável. Pacientes com angina instável utilizaram maior monitorização com Swan-Ganz e suporte com balão intra-aórtico do que os pacientes estáveis. Sobre os desfechos, necessitaram de maior tempo de internação (P=0,030) e apresentaram menor taxa de óbito (P=0,018) no pós-operatório de cirurgia de revascularização do miocárdio isolada.
CONCLUSÃO: Submeter pacientes a cirurgia de revascularização do miocárdio isolada na vigência de síndrome coronariana aguda como angina instável não elevou a taxa de mortalidade.
ABSTRACT
INTRODUCTION: Coronary artery bypass graft is often the treatment of choice for patients who suffer from unstable angina. We do not know whether this condition adds morbidity in this scenario.
OBJECTIVE: To compare the outcomes of patients undergoing coronary artery bypass graft with unstable angina framework with patients who underwent coronary artery bypass graft showed no unstable angina.
METHODS: Retrospective cohort study. Unstable angina was defined as acute coronary syndrome without ST elevation and without enzymatic alteration and/or class IV angina.
RESULTS: Between February 1996 and July 2010, to 2,818 isolated coronary artery bypass graft performed, 1,016 (36.1%) patients had unstable angina. Multivariate analysis showed that patients with preoperative unstable angina used more medications such as acetylsalicylic acid, beta-blocker, heparin (anticoagulation), nitrate and less need for diuretics than patients without unstable angina. Patients with unstable angina used increased monitoring with Swan-Ganz and support with intra-aortic balloon than stable patients. On outcomes, required longer hospitalization (P=0.030) and had a lower death rate (P=0.018) in the post-coronary artery bypass graft alone.
CONCLUSION: Submit patients to coronary artery bypass graft in the presence of acute coronary syndrome such as unstable angina did not increase the mortality rate.
AAS: Ácido acetilsalicílico
AI: Angina instável
AVE: Acidente vascular encefálico
BB: Betabloqueador
BIA: Balão intra-aórtico
CEC: Circulação extracorpórea
CRM: Cirurgia de revascularização do miocárdio
DM: Diabetes mellitus
DRC: Doença renal crônica
EuroSCORE: European System for Cardiac Operative Risk Evaluation
FA: Fibrilação atrial
FEVE: Fração de ejeção do ventrículo esquerdo
GRACE: Global Registry of Acute Coronary Events
HAS: Hipertensão arterial sistêmica
IECA: Inibidores da enzima conversora da angiotensina
IRA: Insuficiência renal aguda
SCASST: Síndrome coronariana aguda sem supradesnivelamento do segmento ST
SPSS: Statistical Package for the Social Sciences
STS: Society of Thoracic Surgeons
TCE: Tronco da artéria coronária esquerda
TIMI: Thrombolysis In Myocardial Infarction
INTRODUÇÃO
A angina instável (AI) é uma das maiores causas de admissão hospitalar, e sua ocorrência está correlacionada com aumento da mortalidade tanto a curto como a longo prazo [1]. Estudos recentes têm demonstrado que o tratamento com angioplastia ou cirurgia de revascularização do miocárdio (CRM) apresentam desfechos menos favoráveis no tratamento de pacientes com quadro de AI em comparação aos portadores de angina estável. Avanços no tratamento e nas técnicas de revascularização tendem a diminuir essa diferença [2,3].
O tratamento da AI pode variar desde estratégia convencional até a abordagem invasiva precoce, podendo ser indicada tanto revascularização percutânea como cirúrgica [4]. A revascularização do miocárdio pode controlar a isquemia persistente e a progressão para o infarto agudo do miocárdio, além de propiciar alívio sintomático, assim como prevenir complicações isquêmicas [5].
Existem diferentes formas de definir AI. Segundo Braunwald, AI é uma angina de peito (ou equivalentes isquêmicos) com, pelo menos, umas dessas três características clínicas: 1) ocorre em repouso (ou com um esforço mínimo), geralmente com duração maior que 20 minutos (se não for interrompida pela nitroglicerina); 2) é intensa e descrita como uma dor franca e de início recente (há menos de 1 mês); 3) ocorre em um padrão em crescendo (ou seja, mais intensa, prolongada ou frequente do que previamente); na ausência de sinais de necrose miocárdica (elevação de enzimas cardíacas). Já o European System for Cardiac Operative Risk Evaluation (EuroSCORE) define AI como dor anginosa em repouso que requer tratamento endovenoso com nitroglicerina até o procedimento cirúrgico. Para fins deste estudo, AI foi definida como síndrome coronariana aguda sem supradesnivelamento do segmento ST (SCASST) e sem alteração enzimática e/ou angina classe IV [6,7].
Segundo as recomendações atuais sobre AI, levando em consideração o risco do paciente, CRM está indicada no caso de lesão importante de tronco da artéria coronária esquerda (TCE); doença triarterial com função ventricular esquerda diminuída (fração de ejeção do ventrículo esquerdo - FEVE <0,5); lesão biarterial com comprometimento proximal da artéria descendente anterior ou função ventricular esquerda diminuída ou presença de isquemia provocada. Também são fatores importantes a expectativa de vida, presença de doenças associadas, gravidade dos sintomas e quantidade de miocárdio viável em risco [5,8,9].
Não está bem definido qual o real impacto da AI no prognóstico dos pacientes submetidos a CRM nesse contexto, nem se há um intervalo de tempo ideal entre o evento agudo e a CRM. O objetivo deste trabalho é analisar as características dos pacientes com quadro de AI e com indicação de CRM e comparar com os pacientes que não apresentaram AI no pré-operatório de CRM, bem como avaliar e comparar os desfechos intra-hospitalares desses pacientes nesse contexto.
MÉTODOS
População e amostra
No período entre fevereiro de 1996 a julho de 2010, foram realizadas 2.818 CRM isoladas no Hospital São Lucas da Pontifícia Universidade Católica do Rio Grande do Sul. Destas, 1.016 (36,1%) pacientes apresentaram AI no período pré-operatório. AI foi definida como SCASST e sem alteração enzimática e/ou angina classe IV.
Delineamento do estudo
Estudo observacional de coorte histórica. Os dados foram coletados prospectivamente e inseridos no banco de dados da unidade de pós-operatório em cirurgia cardíaca da instituição.
Critérios de inclusão
Pacientes com idade igual ou superior a 18 anos submetidos a CRM isolada.
Critérios de exclusão
Foram excluídos da análise cirurgias valvulares isoladas ou combinadas com CRM, CRM realizadas em caráter de urgência ou emergência, infarto agudo do miocárdio com supradesnivelamento do segmento ST no pré-operatório muito recente (< 30 dias), infarto agudo do miocárdio sem supradesnivelamento do segmento ST no pré-operatório muito recente (< 30 dias).
Variáveis do estudo
As variáveis incluídas na análise foram:
• presença de AI no pré-operatório de CRM - realizada análise comparativa com CRM sem AI no pré-operatório;
• idade - foi calculada a média de idade e também dividida em grupos para análise (menor que 60 anos e maior ou igual a 60 anos);
• gênero (masculino ou feminino);
• FEVE - calculada por ecocardiografia, valores divididos para análise em menor que 40% e maior ou igual a 40%;
• doença renal crônica (DRC) - diagnosticada por meio do nível sérico de creatinina sérica > 1,5 mg/dl;
• diabetes mellitus (DM);
• hipertensão arterial sistêmica (HAS);
• infarto agudo do miocárdio recente - definido como síndrome coronariana aguda ocorrida em 30 a 90 dias da cirurgia;
• análise do risco cirúrgico pelo EuroSCORE;
• necessidade de balão intra-aórtico (BIA) no período pré-operatório;
• presença de lesão grave de TCE - considerada quando lesão obstrutiva maior que 50%;
• uso prévio de medicamento - ácido acetilsalicílico (AAS), betabloqueadores (BB), antiarrítmicos (amiodarona e propafenona), digoxina, corticoide, antagonistas dos canais de cálcio, diurético, estatina, heparinização plena, inibidores da enzima conversora da angiotensina (IECA), nitratos, hipoglicemiante oral, insulina;
• necessidade de vasopressor e de monitorização invasiva com cateter de Swan-Ganz;
• tempo de circulação extracorpórea (CEC), todas as CRM utilizaram CEC;
• revascularização completa - considerada quando todos os vasos com calibre maior que 1,5 mm e lesões com obstrução > 50% foram revascularizados;
• uso de revascularização arterial (todos utilizaram enxerto de artéria torácica interna);
• infarto agudo do miocárdio no pós-operatório;
• acidente vascular encefálico (AVE) no pós-operatório;
• fibrilação atrial (FA) no pós-operatório;
• insuficiência renal aguda (IRA) no pós-operatório - considerada como aumento de 50% no valor da creatinina sérica;
• sangramento aumentado no pós-operatório - considera-se sangramento excessivo 200 ml/h ou 3 ml/h/kg nas primeiras duas horas de pós-operatório, ou que persiste em torno de 100 ml/h ou 1,5ml/h/kg a partir da terceira hora;
• necessidade de politransfusão sanguínea, necessidade de transfusão para tratamento de sangramento aumentado que desencadeia anemia significativa (hemoglobina < 8,0 mg/dl) ou alteração hemodinâmica;
• necessidade de reintervenção;
• tempo de internação hospitalar;
• óbito intra-hospitalar no pós-operatório.
Desfechos
Foram analisados taxas de óbito, necessidade de vasopressor, suporte com BIA e tempo de internação no pós-operatório de CRM.
Procedimentos
A anestesia, as técnicas de CEC e de cardioplegia (solução de St. Thomas número 2) foram realizadas de acordo com a padronização da instituição, conforme previamente descrito [10]. Após a cirurgia, todos os pacientes foram transferidos para a unidade de tratamento intensivo de pós-operatório em cirurgia cardíaca, em ventilação mecânica.
Análise estatística
Os dados foram plotados em uma planilha eletrônica Microsoft Access® e analisados no programa estatístico Statistical Package for the Social Sciences (SPSS) Versão 11.0. A estatística descritiva foi realizada, bem como os testes univariados: teste do qui-quadrado, para variáveis ordinais e para dados quantitativos foi usado análise de variância ou teste t de Student (para variáveis não pareadas) seguido de teste post hoc para dados de Bonferroni.
A análise multivariada foi feita por regressão logística (método backward conditional). Foram consideradas diferenças estatísticas P<0,05.
Considerações éticas
O projeto de pesquisa de estudo foi submetido ao Comitê de Ética em Pesquisa da Faculdade de Medicina da Pontifícia Universidade Católica do Rio Grande do Sul, com registro o número 06003478.
RESULTADOS
No período entre fevereiro de 1996 a julho de 2010, foram realizadas 2.818 CRM isoladas com emprego de CEC. Destas, 1.016 (36,1%) pacientes apresentaram AI no pré-operatório. A idade média da população estudada com AI no pré-operatório foi de 60,42 ± 10 anos, FEVE média de 54,05 ± 15%, tempo de CEC de 85,54 ± 34 minutos, média de uso de enxerto mamário em 74,1% e taxa média de revascularização incompleta de 6,8%. Todas essas características foram semelhantes entre o grupo com AI e sem AI no pré-operatório de CRM.
Quanto ao risco cirúrgico, avaliado pela análise logística do EuroSCORE, a média entre os pacientes com AI no pré-operatório de CRM foi de 5,19, comparado com 3,30 entre os pacientes sem AI no pré-operatório (P=0,012). O tempo médio de internação hospitalar foi de 10,96 ± 9,74 dias, já o tempo de espera para a realização da CRM foi, em média, de 9,18 dias, apresentando intervalo maior para os pacientes com AI (11,7 dias) em comparação com os sem AI (7,8 dias) (OR: 1,30; IC 95% 1,29-6,41; P=0,003). O tempo de pós-operatório foi semelhante entre os grupos, no total, a média foi de 10,5 dias; nos pacientes com AI, 10,99 dias, e sem AI, 10,27 dias (OR: 0,36; IC 95% 0,006-1,42; P=0,048). O tempo de internação mais prolongado nos pacientes com AI no pré-operatório (10,96 dias versus 10,27 dias) foi à custa de maior tempo de espera para a realização da CRM.
As características pré-operatórias e pós-operatórias e dados da análise univariada são apresentados nas Tabelas 1 e 2, respectivamente. A Tabela 3 descreve as características e desfechos clínicos no pós-operatório de CRM isolada nos pacientes com AI no pré-operatório, com significância estatística.
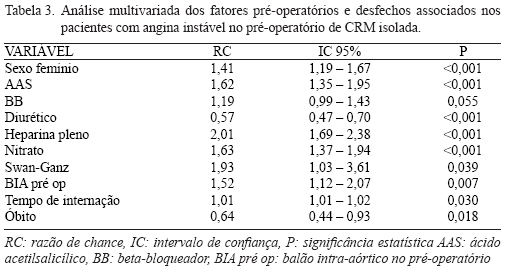
Por meio da análise univariada observou-se que o sexo feminino foi mais predominante entre os pacientes com AI no pré-operatório de CRM, além disso, esses pacientes utilizaram mais BIA no pré-operatório, e medicações como AAS, IECA, nitrato, heparina e BB. Já o uso de diurético foi menor nesse grupo de pacientes (Tabela 1).
Com relação à evolução pós-operatória, não houve diferença quanto a desfechos como infarto agudo do miocárdio, AVE, disfunção renal aguda e necessidade de vasopressor entre os pacientes que apresentaram AI no pré-operatório e os que não apresentaram. Mesmo com maior taxa de utilização de AAS e heparina nos pacientes com AI no pré-operatório de CRM, não houve diferença entre os grupos em relação a sangramento: 12% no grupo com AI e 10,7% no grupo sem AI (OR: 1,14; IC 95% 0,89-1,45; P=0,29), necessidade de reintervenção: 4,1% no grupo com AI e 5,3% no grupo sem AI (OR: 0,77; IC 95% 0,53-1,12; P=0,17), já a necessidade de politransfusão apresentou tendência a ser maior no pacientes com AI (OR: 1,22; IC 95% 1,02-1,45; P=0,027), não se confirmando na análise multivariada. O tempo de CEC foi semelhante entre os grupos com valores >90 minutos em 37,9% no grupo com AI comparado a 40,7% no sem AI (OR: 0,89; IC 95% 0,75-1,04; P=0,98), O uso de cateter de Swan-Ganz foi maior no grupo de pacientes com AI no pré-operatório (Tabela 2).
A análise multivariada demonstrou que os pacientes com AI no pré-operatório de CRM isolada eram em sua maioria do sexo feminino, utilizaram mais medicações como AAS, BB, heparina (anticoagulação plena), nitrato e necessitaram de menos diureticoterapia. Maior número de pacientes recebeu monitorização com cateter de Swan-Ganz e suporte com BIA (Tabela 3).
A taxa total de óbito na população estudada foi de 5,4%, sendo que os pacientes com AI apresentaram menor taxa de óbito; 4,1% em comparação aos sem AI no pré-operatório com taxa de 6,1%; dados com significância estatística (OR: 0,64; IC 95% 0,443-0,925; P=0,018), com efeito protetor de 36% de óbitos para pacientes com AI no pré-operatório de CRM. O tempo de internação foi maior nos pacientes com AI, necessitando de 10,96 dias em comparação a 10,27 dias dos pacientes sem AI (OR: 1,009; IC 95% 1,001-1,018; P=0,030), essa diferença foi decorrente do maior tempo de espera para realização da CRM nos pacientes com AI (Tabela 3).
Diante do longo período analisado, no período de 1996 até 2010, e considerando as mudanças no manejo das síndromes coronarianas agudas ocorridas nesse período, incluindo AI, como o benefício dos BB, estatinas, IECA e manutenção do AAS para os pacientes com AI que irão para CRM, realizamos uma análise comparando dois períodos distintos, como demonstrado nas Figuras 1 e 2. Por meio dessa análise, concluímos que os pacientes com AI tratados de 1996 a 2003 receberam mais BB, IECA, AAS, heparinização plena e nitrato, e menor uso de diurético, e que a taxa de óbito (3% versus 5,3%) foi significativamente menor nesse grupo, comparado aos sem AI (P=0,028). Já os pacientes tratados de 2004 a 2010 com AI receberam mais AAS, estatinas, heparinização plena e nitrato, e menor uso de diurético, porém sem diferença no tratamento de BB, IECA, apresentando taxa de óbitos semelhantes (6,4% versus 7,7%) e maiores em comparação com o período anterior, talvez pela maior complexidade dos pacientes submetidos a CRM com a evolução do tempo (mais idosos, com maior número de comorbidades).


DISCUSSÃO
Os escores de risco que calculam o risco de mortalidade operatória e morbidade da cirurgia cardíaca de adultos com base em variáveis demográficas e clínicas, como o EuroSCORE e a Society of Thoracic Surgeons (STS), consideram a AI como risco adicional aos pacientes submetidos a CRM, merecendo pontuação em seus escores, porém quando isolada não altera o risco. Assim, quando os pacientes apresentam AI como fator de risco isolado, estes se mantêm como de baixo risco. Já o escore desenvolvido no serviço do Hospital São Lucas da Pontifícia Universidade Católica do Rio Grande do Sul não encontrou risco aumentado de mortalidade operatória e intra-hospitalar no pós-operatório de CRM nos pacientes com quadro de AI, não recebendo pontuação nesse escore [11].
O uso de cateter de Swan-Ganz foi significativamente fequente nos pacientes com AI no pré-operatório de CRM. A maior monitorização invasiva não foi relacionada com maiores taxas de choque cardiogênico, infarto pós-operatório ou sepse, já o uso de diurético foi significativamente menor nesse grupo de pacientes (razão de chance de 0,57), possivelmente devido ao uso dessa ferramenta. O maior uso de Swan-Ganz poderia estar relacionado como um marcador de gravidade para esse grupo de pacientes. Apesar disso, a obtenção de parâmetros hemodinâmicos específicos contribuiu para menores desfechos no pós-operatório.
A monitorização da reposição de fluídos é aspecto fundamental para que sejam evitadas as complicações causadas pela sobrecarga ou falta de volume no espaço intravascular. O uso de monitorização hemodinâmica invasiva no pós-operatório de cirurgia cardíaca em pacientes que apresentam instabilidade hemodinâmica é útil na orientação do controle da volemia, uso de drogas vasoativas, necessidade de assistência circulatória. Outro fato a ser destacado é que não há correlação fidedigna entre a pressão venosa central e a pressão capilar pulmonar, e que o controle da volemia segundo a pressão venosa central não é seguro [12]. Entretanto, estudos demonstram que esses valores apresentam alguma imprecisão quanto à avaliação da volemia, principalmente nos pacientes em ventilação mecânica, devido às mudanças no volume sistólico induzidas pela pré-carga, que dependem também da contratilidade e da pós-carga, que não são avaliadas por esses parâmetros.
Outros métodos, como a ecocardiografia transesofágica e o Doppler transesofágico, com medidas de fluxo aórtico e volume diastólico final, são opções interessantes com inconveniente de depender de operador experiente e não poderem ser utilizados de forma continuada por longo período de tempo. Outro indicador sensível de resposta à volemia em pacientes sob ventilação mecânica seria a variação da pressão arterial sistólica e sua down, com boa correlação com a deflexão negativa e a infusão de fluidos e melhora concomitante no débito cardíaco e elevação das pressões de enchimento atriais [13].
A necessidade de BIA também foi significativamente maior no grupo com AI, podendo representar a maior gravidade desses em comparação com o grupo sem evento agudo no pré-operatório de CRM isolada. A indicação do BIA em nossa instituição está limitada à fração de ejeção baixa (<30%), choque cardiogênico, lesão de TCE grave (>50%) e angina intratável, sendo esse último o principal motivo do uso neste trabalho. Mesmo necessitando desse suporte no pré-operatório, as taxas de óbito foram menores.
Os benefícios do BIA foram estudados por Santarpino et al. [14], que avaliaram o uso desse dispositivo no pré-operatório de CRM de alto risco (EuroSCORE >12) e encontraram desfechos semelhantes aos da CRM de baixo risco (EuroSCORE <5) sem o dispositivo, com baixas taxas de complicações associadas, defendendo o uso mais liberal do BIA, especialmente em CRM de alto risco. Macruz et al. [15] analisaram, retrospectivamente, o uso precoce (intraoperatório) e tardio (pós-operatório) do BIA. Foram estudados 130 pacientes do Texas Heart Institute. Os dados deste estudo sugerem que o BIA é efetivo como método de suporte circulatório, em pacientes com baixo débito cardíaco após CEC, havendo tendência a resultados melhores quando usado precocemente; foi observada influência da idade e do tempo de CEC, sugerindo que métodos mais eficientes de assistência circulatória devam ser usados nos pacientes mais idosos e nos pacientes com síndrome de baixo débito cardíaco pós-cirurgia cardíaca com tempos de CEC maiores que 120 minutos.
O sexo feminino apresentou razão de chance de 1,4 para AI no pré-operatório de CRM. Acredita-se que o comportamento da doença arterial coronariana é diferente entre os gêneros. Campbell et al. [16] compararam a análise histológica da estrutura do miocárdio e da microvasculatura coronariana de homens e mulheres e encontraram diferenças na parede das arteríolas e na razão entre o miócito cardíaco e a área de superfície corporal que podem justificar a presença de sintomas isquêmicos mais frequentes no sexo feminino, embora nem sempre se correlacionem a doença arterial coronariana mais grave que no masculino. Hasdai et al. [17] analisaram desfecho de 10.000 pacientes após síndrome coronariana aguda em relação ao gênero e observaram nesse registro que o sexo feminino apresentava idade mais avançada, sem associação com mortalidade aumentada, menor emprego de antiplaquetários (como os inibidores da glicoproteína IIbIIIa) e menor uso de BB, antiplaquetários e estatina, e mais diuréticos e digoxina, na alta hospitalar [17]. Apesar de estudos apontarem o sexo feminino como indicador de risco para CRM e fazer parte dos escores [18], outros não confirmam esse risco no contexto de síndrome coronariana aguda [19-21], assim como o presente trabalho.
O tempo de internação foi mais prolongado nos pacientes com AI no pré-operatório de CRM, à custa de maior tempo de espera para a realização da CRM, e não em decorrência da ventilação prolongada, necessidade de vasopressores, sepse e delírio. Não há recomendações claras sobre qual o tempo de espera ideal para realização de CRM após AI. As vantagens da CRM precoce para o tratamento da AI incluem limitação da área de isquemia e do remodelamento do ventrículo esquerdo, entretanto, podem levar a injúria de reperfusão e o dano adicional ao miocárdio, aumentando assim a resposta inflamatória sistêmica [22].
O intervalo de tempo ideal entre a síndrome coronariana aguda e a CRM ainda é controverso. O registro PL-ACS incluiu 2028 pacientes com síndrome coronariana aguda, em que 55% apresentavam AI e indicação de CRM, 60% foram submetidos a cirurgia em diferentes intervalos de tempo. Concluíram que, após 12 meses de espera para CRM, o risco de óbito eleva-se em duas vezes e que CRM realizada durante o primeiro mês após a síndrome coronariana aguda está associada a aumento da prevalência de mortalidade, considerando o ideal o intervalo de espera entre 1 e 3 meses [22]. Resultado diferente do encontrado neste trabalho, em que o tempo de espera médio foi de 11,7 dias; não relacionado com aumento da mortalidade, provavelmente por não incluir pacientes com infarto agudo do miocárdio transmural.
Weiss et al. [23], em um estudo com análise de registro mais de 40.000 pacientes com síndrome coronariana aguda, incluindo infarto transmural, observaram que pacientes submetido a CRM em 2 dias da hospitalização apresentaram taxas de mortalidade mais elevada do que aqueles que foram levados a cirurgia com tempo de espera de 3 ou mais dias de hospitalização, em casos não urgentes, sugerindo que o intervalo de tempo ideal entre CRM após síndrome coronariana aguda deveria ser maior ou igual a 3 dias. Costa et al. [24] encontraram dados semelhantes após compararem desfechos entre dois grupos de pacientes com tempo de espera menor que 30 dias e maior que 30 dias submetidos a CRM: a mortalidade global foi de 5,9% (1 óbito em 15 pacientes para o Grupo I; 1 óbito em 19 pacientes para o Grupo II; P=1,0). Esses autores defenderam que a CRM pode ser feita com segurança, especialmente após as primeiras 72 horas do evento isquêmico.
A AI no pré-operatório de CRM isolada, diferente do esperado, demonstrou menor taxa de mortalidade intra-hospitalar, neste trabalho, em comparação ao grupo sem AI, mesmo apresentando maior risco cirúrgico avaliado pela análise logística do EuroSCORE (5,19 comparado com 3,30 dos pacientes sem AI no pré-operatório P=0,012). Possivelmente pelo fato de que essa amostra de pacientes com quadro de AI tenha recebido tratamento medicamentoso otimizado, em comparação ao grupo que não apresentou AI, como o maior uso de AAS, BB, heparina plena e nitrato (razão de chance de 1,62, 1,19, 2,01, 1,63, respectivamente) em comparação aos que não apresentaram o evento agudo. Já o uso de diurético foi significativamente menor nesse grupo de pacientes (razão de chance de 0,57). Esse fato revela a importância no manejo medicamentoso otimizado em todos os grupos.
A taxa de mortalidade média foi de 5,4%. A mortalidade observada no grupo de pacientes com AI pré-operatória submetidos a CRM isolada foi de 4,1% versus 6,1% do grupo sem o evento agudo, nesta análise. A taxa de óbito é similar à apresentada por outros autores, como Kaul et al. [18] (5,9%), Hochman et al. [25] (4,3%), Howard et al. [26] (4,3%) e Jatene et al. [21] (4,1%), no contexto da síndrome coronariana aguda. Porém, quando comparamos as médias de óbito por períodos, observamos que há diferença significativa ao analisar o período entre 1996 a 2003 (4,3%) e de 2004 a 2010 (7,3%) P=0,001; apesar dos avanços no tratamento e no manejo dos pacientes isquêmicos submetidos à CRM, com maior uso de estatina, BB, IECA e AAS, fato que pode ser explicado pelo aumento da complexidade dos pacientes submetidos a CRM, com maior número de comorbidades, idade avançada e doenças mais complexas.
Ao avaliar os pacientes com AI submetidos a CRM isolada, no período de 1996 a 2003, observamos que esse grupo de pacientes apresentou menor taxa de mortalidade em comparação aos sem AI e que não houve diferença significativa na taxa de óbitos entre os pacientes com AI e sem AI, no período de 2004 a 2010. Nesse período, o tratamento clínico otimizado não pareceu reduzir a mortalidade, talvez por ambos os grupos desse período apresentarem tratamento clínico e manejo mais uniforme, principalmente quanto ao uso de BB e IECA.
Limitações
Embora a coleta de dados tenha sido realizada de forma prospectiva, a análise dos dados foi realizada de forma retrospectiva, e os dados não foram coletados com o objetivo específico desta análise. Sendo assim, algumas questões importantes não foram levantadas, como a avaliação de risco segundo escores de síndrome coronariana aguda como Thrombolysis In Myocardial Infarction (TIMI) escore ou Global Registry of Acute Coronary Events (GRACE), o que possibilitaria uma avaliação mais detalhada quanto à gravidade dos pacientes no pré-operatório. Outra limitação é o acompanhamento do paciente, realizado até a alta hospitalar, não temos dados dos desfechos após este momento.
CONCLUSÃO
O presente estudo observou que os pacientes com AI submetidos a CRM isolada não demonstraram aumento de mortalidade, ao contrário, possivelmente por terem recebido melhor tratamento medicamentoso, e monitorização invasiva e suporte hemodinâmico com maior frequência, os pacientes com AI apresentaram taxas de óbito menores, do que aqueles considerados estáveis.
REFERÊNCIAS
1. Movahed MR, John J, Hashemzadeh M, Hashemzadeh M. Mortality trends for non-ST-segment elevation myocardial infarction (NSTEMI) in the United States from 1988 to 2004. Clin Cardiol. 2011;34(11):689-92. [MedLine]
2. Feyter PJ, Serruys PW, Unger F, Beyar R, Valk V, Milo S, et al. Bypass surgery versus stenting for the treatment of multivessel disease in patients with unstable angina compared with stable angina. Circulation. 2002;105(20):2367-72. [MedLine]
3. Luksienè D, Milvidaitè I, Slapikas R, Jarusevicius G, Siudikas A, Venclovienè J, et al. The impact of myocardial revascularization after acute coronary syndromes on one-year cardiovascular mortality. Medicina (Kaunas). 2011;47(6):305-12. [MedLine]
4. Weber MM. Surgical management of unstable angina and symptomatic coronary artery disease. J Cardiovasc Nurs. 2000;15(1):27-42. [MedLine]
5. Sociedade Brasileira de Cardiologia. Guidelines for Unstable Angina and Non-ST-Segment Elevation Myocardial Infarction of the Brazilian Society of Cardiology (II Edition, 2007). Arq Bras Cardiol. 2007;89(4):e89-131. [MedLine]
6. Bonow RO, Zipes DP, Libby P. Braunwald: tratado de doenças cardiovasculares. 8ª ed. Rio de Janeiro:Elsevier; 2009. p.1319.
7. Naschef SA, Roques F, Michel P, Gauducheau E, Lemeshow S, Salamon R. European system for cardiac operative risk evaluation (EuroSCORE). Eur J Cardiothorac Surg. 1999;16(1):9-13. [MedLine]
8. Hillis LD, Smith PK, Anderson JL, Bittl JA, Bridges CR, Byrne JG, et al. 2011 ACCF/AHA Guideline for Coronary Artery Bypass Graft Surgery: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation. 2011;124(23):e652-735. [MedLine]
9. Task Force on Myocardial Revascularization of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS); European Association for Percutaneous Cardiovascular Interventions (EAPCI), Wijns W, Kolh P, Danchin N, Di Mario C, Falk V, Folliguet T, et al. Guidelines on myocardial revascularization. Eur Heart J. 2010;31(20):2501-55. [MedLine]
10. Guaragna JCVC. Cirurgia cardíaca e hipertensão arterial no pós-operatório imediato: fatores pré e transoperatórios [Dissertação]. Porto Alegre: Pontíficia Universidade Católica do Rio Grande do Sul; 1999.
11. Cadore MP, Guaragna JCVC, Anacker JFA, Albuquerque LC, Bodanese LC, Piccoli JCE, et al. Proposição de um escore de risco cirúrgico em pacientes submetidos à cirurgia de revascularização miocárdica. Rev Bras Cir Cardiovasc. 2010;25(4):447-56. [MedLine] Visualizar artigo
12. Dragosavac D, Araújo S, Carieli MCM, Terzi RGG, Dragosavac S, Vieira RW. Monitorização hemodinâmica invasiva no pós-operatório de cirurgia cardíaca. Arq Bras Cardiol. 1999;73(2):129-38. [MedLine]
13. Carlos RV, Bittar CS, Lopes MR, Auler Júnior JOC. Variação da pressão sistólica como método diagnóstico da hipovolemia durante anestesia para cirurgia cardíaca. Rev Bras Anestesiol. 2005;55(1):3-18. [MedLine]
14. Santarpino G, Onorati F, Rubino AS, Abdalla K, Caroleo S, Santangelo E, et al. Preoperative intraaortic ballon pumping impoves outcomes for high-risk patients in routine coronary artery bypass graft surgery. Ann Thorac Surg. 2009;87(2):481-8. [MedLine]
15. Macruz HMS, Frazier OH, Cooley DA. Análise dos resultados do uso precoce e tardio da assistência circulatória com balão intra-aórtico (BIA) em pacientes submetidos a correção de cardiopatias com auxílio de circulação extracorpórea. Rev Bras Cir Cardiovasc. 1995;10(4):190-7. Visualizar artigo
16. Campbell DJ, Somaratne JB, Jenkins AJ, Prior DL, Yii M, Kenny JF, et al. Differences in myocardial structure and coronary microvasculature between men and women with coronary artery disease. Hypertension. 2011;57(2):168-92.
17. Hasdai D, Porter A, Rosengren A, Behar S, Boyko V, Battler A. Effect of gender on outcomes of acute coronary syndromes. Am J Cardiol. 2003;91(12):1466-9.
18. Kaul TK, Fields BL, Riggins SL, Dacumos GC, Wyatt DA, Jones CR. Coronary artery bypass grafting within 30 days of an acute myocardial infarction. Ann Thorac Surg. 1995;59(5):1169-76. [MedLine]
19. Naunheim KS, Kesler KA, Kanter KR, Fiore AC, McBride LR, Pennington DG, et al. Coronary artery bypass for recent infarction. Predictors of mortality. Circulation. 1988;78(3 Pt 2):I122-8. [MedLine]
20. Applebaum R, House R, Rademaker A, Garibaldi A, Davis Z, Guillory J, et al. Coronary artery bypass grafting within thirty days of acute myocardial infarction. Early and late results in 406 patients. J Thorac Cardiovasc Surg. 1991;102(5):745-52. [MedLine]
21. Jatene FB, Nicolau JC, Hueb AC, Atik FA, Barafiole LM, Murta CB, et al. Fatores prognósticos da revascularização na fase aguda do infarto agudo do miocárdio. Rev Bras Cir Cardiovasc. 2001;16(3):195-202. Visualizar artigo
22. Zembala M, Trzeciak P, Gasior M, Gierlotka M, Hudzik B, Taistra M, et al. Optimal timing for surgical revascularization in survivors of acute coronary syndromes elegible for elective coronary artery bypass graft surgery. Int J Cardiol. 2011;153(2):173-8. [MedLine]
23. Weiss ES, Chang DD, Joyce DL, Nwakanma LU, Yuh DD. Optimal timing of coronary artery bypass after acute myocardial infarction: a review of California discharge data. J Thorac Cardiovas Surg. 2008;135(3):503-11.
24. Costa WA, Santos JMV, Sampaio DT, Lobo Jr. NC, Figueroa CCS. Cirurgia de revascularização do miocárdio no paciente infartado: quando operar? Rev Bras Cir Cardiovasc. 1999;14(1):19-26. Visualizar artigo
25. Hochman JS, Boland J, Sleeper LA, Porway M, Brinker J, Col J, et al. Current spectrum of cardiogenic shock and effect of early revascularization on mortality. Results of an International Registry. SHOCK Registry Investigators. Circulation. 1995;91(3):873-81. [MedLine]
26. Howard M, Irarrazaval MJ, Corbalán R, Morán S, Zalaquett R, Maturana G, et al. Surgical myocardial revascularization during the 1st 15 days of evolution of acute myocardial infarction. Rev Med Chil. 1996;124(1):37-44. [MedLine]
Authors' roles & responsibilities
CPS: Autor principal
JCG: Coautor
RSC: Coautor
JP: Coautor
LCA: Coautor
MAG: Coautor
JBP: Coautor
LCB: Coautor
Article receive on segunda-feira, 25 de junho de 2012
 All scientific articles published at www.bjcvs.org are licensed under a Creative Commons license
All scientific articles published at www.bjcvs.org are licensed under a Creative Commons license