bjetivo: Avaliar o fluxo, a pressão de ruptura, a necessidade de pontos de reforço, em artérias suturadas, reforçadas ou não com selante de fibrina após uma secção transversal.
Método: Utilizou-se como selante o Tissucol®. Dezessete suínos, Landrace ligth, pesando entre 15 e 20 kg, tiveram suas artérias femorais e carótidas seccionadas após heparinização, anastomosadas em plano único contínuo de prolene 7-0. Usamos 68 amostras arteriais, 34 no grupo tratamento e 34 no grupo controle. Uma artéria carótida e uma femoral receberam, selante de fibrina, aleatoriamente; o lado contralateral foi o controle. Anotava-se a necessidade e o número de pontos de reforço. Após 10 minutos da infusão de protamina, sacrificavam-se os animais, cateterizavam-se as artérias. Estas artérias foram mensuradas, colocadas num fluxômetro, onde se avaliava a velocidade do fluxo. As artérias foram submetidas à infusão de ar, com pressões sucessivamente mais elevadas, mergulhadas em solução de NaCl a 0,9%, observando-se o primeiro vazamento aéreo. Analisaram-se os dados estatisticamente.
Resultados: Os diâmetros externos e a espessura das artérias, além da pressão de ruptura e número de amostra com ruptura superior a 200mmHg, foram semelhantes. Contudo, o selante diminuiu o número de pontos de reforço.
Conclusão: O selante de fibrina reduz a necessidade de pontos adicionais.
Objectives: To evaluate the flow, tear pressure, the need of reinforcement stitches in sutured arteries reinforced or not using fibrin sealant after a cross-section.
Method: Tissucol® fibrin sealant was used. The femoral and carotid arteries of seventeen swine from the same breed (weighing from 15 to 20 kg) were cross-sectioned after heparinization and subjected to anastomoses using a single continuous plane of prolene 7-0. We worked with 68 artery samples, 34 in the Treatment Group and 34 in the Control Group. For each animal, one carotid and one femoral artery randomly received fibrin sealant with the contralateral side being used as a control. The need and the number of reinforcement stitches were recorded. Ten minutes after protamine infusion, the animals were sacrificed and the arteries were catheterized. The arteries were measured and placed on a flow meter. The arteries were then subjected to air infusion at increasingly higher pressures (stepwise increases of 25 mmHg), the grafts were dipped in saline solution, the first air leakage was observed and the tear pressure recorded.
Results: The external diameters and thickness of the arteries were similar in both the Treatment and Control Group. There was no significant difference between the groups regarding the tear pressure (p=0.329), flow rate (p=0.943) and the number of samples with a tear pressure above 200 mmHg. However, the sealant reduced the number of reinforcement stitches necessary (p=0.029).
Conclusion: Fibrin sealant reduces the need of additional stitches.
INTRODUÇÃO
Apesar do uso freqüente de selantes em suturas arteriais, o número de trabalhos experimentais na literatura sobre o assunto é pequeno. O primeiro relato do uso de selantes em cirurgia cardiovascular foi realizado por Brawnwald, em 1966 [1,2]. Os selantes são utilizados rotineiramente como: agente hemostático [3-7], em suturas arteriais [8,9], reforço no tratamento cirúrgico de afecções da aorta [10-12] e outras doenças cardíacas estruturais, como comunicação interventricular (CIV) pós-infarto agudo do miocárdio e cardiopatias congênitas. Alguns estudos experimentais têm sido realizados para confecção de anastomoses arteriais sem pontos [13,14]. Outros estudos averiguaram o seu efeito angiogênico [15].
Entretanto, nenhum artigo avaliou o reforço que o selante proporciona em uma sutura arterial, apesar de muitos cirurgiões usarem o selante com este propósito. O selante de fibrina, por ser derivado do sangue, apresenta riscos inerentes a sua utilização, como: infecções causadas por transfusões sangüíneas, além de parvovirose B19 [16], sensibilização, com deficiência de fator V e anticorpos antitrombina; além do risco de embolização. Sendo assim, é mister verificar a eficácia do uso do selante de fibrina. Este estudo tem como objetivo avaliar a pressão de ruptura, o fluxo, além da necessidade de pontos de reforço, em artérias suturadas após uma secção transversal, e reforçadas ou não com selante de fibrina Tissucol®.
MÉTODO
Todos os animais foram tratados seguindo-se as normas éticas do Colégio Brasileiro de Experimentação Animal (COBEA), com aprovação do protocolo de trabalho pelo departamento de Cirurgia da Faculdade de Medicina da UFMG. A anestesia foi realizada, com infusão de Quetamina (15mg/kg intramuscular) e Xilazina (12,5mg/kg intramuscular). Após cateterização de uma veia periférica, com Jelco® no 20, foi infundido Pentobarbital (12,5 mg/kg endovenoso). Após receberem 1mg de heparina por kg de peso, 17 suínos de uma mesma linhagem (Landrace Ligth), com peso variando entre 15 e 20 Kg, tiveram suas artérias femorais e carótidas ocluídas com clamp cirúrgico e seccionadas transversalmente. A seguir, as artérias foram anastomosadas em plano único de sutura, utilizando-se fio de polipropileno 7-0, em pontos contínuos (Figura 1).
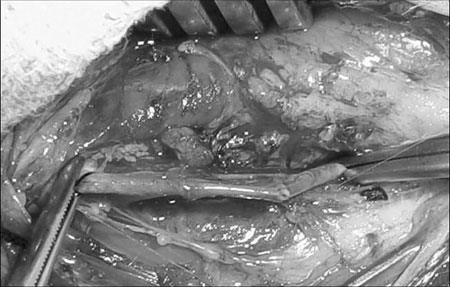
Fig. 1 - Aspecto final da anastomose arterial
Foram estudadas 68 amostras arteriais, divididas em dois grupos: 34 no grupo tratamento e 34 no grupo controle. Em cada animal, uma artéria carótida e uma artéria femoral, definidas por sorteio, depois da confecção da anastomose e antes da aplicação do selante, receberam 1 ml de selante de fibrina ao longo da anastomose, sendo o lado contra-lateral seu controle (Figura 2).
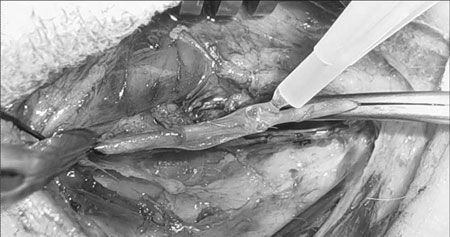
Fig. 2 - Anastomose recebendo o selante de fibrina
Após a abertura do clamp, anotava-se a necessidade e o número de pontos adicionais, para realização da hemostasia adequada da anastomose. Sangramentos que proporcinaram jatos de sangue foram reforçados. Após 10 minutos da infusão venosa de protamina, os animais foram submetidos à eutanásia com aprofundamento anestésico e infusão de KCl até a fibrilação ventricular.
A seguir, cada segmento de artéria envolvendo a anastomose foi ressecado, em uma extensão correspondente a 1cm proximal e 1cm distal à anastomose. Estas artérias tinham seu diâmetro e espessura medidos com paquímetro de precisão, quando submetidas a 25mmHg de pressão. As amostras arteriais foram cateterizadas e lavadas com 10ml de NaCL a 0,9% e colocadas num fluxômetro, onde se avaliava a velocidade do fluxo. A unidade de trabalho foi em segundos onde foram escoados 10 ml de solução fisiológica de NaCl a 0,9% pelo fluxômetro a 50 cm de altura (Figura 3).

Fig. 3 - Fluxômetro montado
Logo após, as artérias eram então imersas em solução de NaCl a 0,9%, e submetidas à infusão de ar com pressões progressivamente mais elevadas, aumentadas de 25 em 25 mmHg. No momento exato em que ocorria vazamento aéreo, anotava-se a pressão de ruptura (Figuras 4 e 5).

Fig. 4 - Amostra arterial demonstrando a avaliação da pressão de ruptura
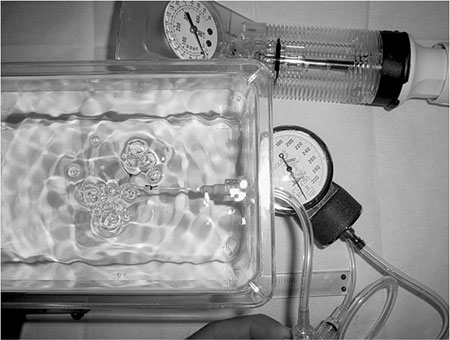
Fig. 5 - Amostra arterial mostrando o momento da ruptura e o vazamento aéreo
Foram comparados o número de amostras com pressão de ruptura superior a 200mmHg. A pressão de 200mmHg foi escolhida, como ponto de corte, por ser considerada supra-sistêmica. Contudo, somente quando as amostras atingiram a pressão de 300 mmHg foi considerada ausência de ruptura. O tamanho da amostra foi aferido estatisticamente, demonstrando ser adequado. Para a análise estatística foi utilizado o gerenciador de dados Epinfo. Todos os resultados foram submetidos a testes estatísticos de hipótese considerando cada parâmetro estudado. As variáveis contínuas foram estudadas pelo teste t-Student ou equivalente não paramétrico Kurskall-Wallis (quando indicado), e as variáveis categóricas pelo Qui-quadrado (com correção de Yates) ou teste exato de Fisher (quando indicado), além do teste de t. Para todas as análises, o nível de significância foi considerado de 5% (á = 0,05).
RESULTADOS
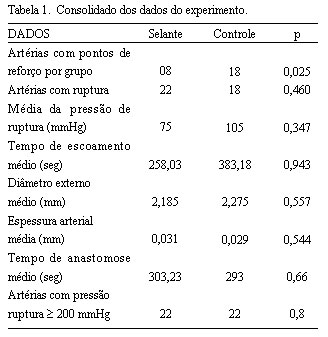
O número de anastomoses com necessidade de pontos de reforço foi oito para o grupo selante (n=34) e 18 para o grupo controle (n=34), com diferença significativa calculada pelo qui-quadrado com correção de Yates (p=0,025).
A média da pressão de ruptura das artérias foi de 75,72 mmHg para o grupo com selante e 105,88 mmHg para o grupo controle. Valores calculados pelo teste de t de Student. O número de artérias que romperam foi de 22 no grupo tratado com selante e 18 no grupo controle, sem significância ao teste de Qui-quadrado com correção de Yates (P=0,460). O tempo médio gasto para o escoamento de 10 ml de NaCl a 0,9 % a partir de uma altura de 50 cm, foi de 383,18 segundos no grupo controle e 258,03 segundos para o grupo tratado com selante de fibrina. Esta diferença, avaliada pelo teste de t de Student, não foi significativa (p=0,943). As médias dos diâmetros externos foram semelhantes em ambos os grupos, sendo 2,185 mm no grupo controle e 2, 276 mm no grupo tratamento. Este resultado não se mostrou significativo quando examinado pelo teste de t de student (p=0,557). A espessura dos enxertos arteriais foi também semelhante, sendo 0,029 mm no grupo controle e 0,030 mm no grupo tratamento. Este resultado também não foi significativo quando avaliado pelo teste de t de student (p= 0,544). O tempo médio para confecção das anastomoses foi semelhante: 303,23 segundos para o grupo tratamento e 293,85 segundos para o grupo controle (p=0,59). Os dados foram analisados pelo teste de t de student. O número de enxertos com pressão de ruptura acima de 200 mmHg foi de 22 para ambos os grupos. A Tabela 1 sumariza os resultados obtidos neste estudo.
Ao longo dos últimos 10 anos, diversos estudos sugeriram que os selantes podem reforçar as paredes do enxerto de safena ou a parede da aorta em casos de dissecção, CIV pós-infarto, corrigida cirurgicamente. Neste estudo, não foram encontrados dados suficientes para sustentar esta hipótese. A pressão de ruptura dos enxertos tratados com o selante foi semelhante a dos enxertos não tratados (p=0,347). Não foi possível comparar estes dados com a literatura devido à inexistência de dados semelhantes. Desta forma, neste estudo não se constatou a capacidade de reforço do selante de fibrina em anastomoses arteriais.
A técnica de lavar a amostra arterial com NaCl a 0,9 %, antes de aferir o fluxo da mesma, pode ter contribuído para a ausência de diferença de tempo de fluxo entre os grupos. Apesar de a solução salina ter viscosidade inferior à do sangue, ela se presta ao estudo, cujo objetivo é, simplesmente, comparar o fluxo das artérias que usam o selante com o grupo controle.
Alguns autores sugerem que o selante de fibrina pode reforçar a parede de enxertos de safena utilizados em um modelo ex vivo, fazendo análise microscópica dos enxertos de safena submetidos à pressão subsistêmica (60mmHg), em fluxo contínuo [17]. Isto cria uma situação artificial, em que ocorre um menor número de lesões microscópicas, com o uso do selante, contudo, dificulta a extrapolação dos resultados para a prática médica.
Neste presente trabalho, não foi evidenciada qualquer alteração do fluxo, entre os grupos, talvez por termos irrigado cada enxerto com 10 ml de NaCl a 0,9 %, antes do teste de fluxo, conforme o protocolo inicial. A intenção em se usar este método, foi evitar a interferência de qualquer coágulo, formado durante a ressecção das amostras, na pressão de ruptura. Este processo dificultou a conclusão sobre o potencial embólico do selante de fibrina, devido à possibilidade de remover, da luz arterial, eventuais coágulos gerados pelo selante de fibrina penetrados através de pequenos orifícios na linha de sutura (Figura 6). Existem trabalhos que provam que a quanto maior a concentração de trombina, mais rápido se faz a fibrina estável. Quando maior sua concentração, maior risco de embolia. Frost-Arner et al.[18] demonstraram que concentrações menores de trombina aumentam a perviedade da anastomose.

Fig. 6 - Presença de êmbolo de fibrina no interior de uma amostra
Apesar da indicação de pontos de reforço ser baseada na impressão do pesquisador, podemos tomar os dados como válidos, pois toda experimentação foi realizada por um só cirugião. A diminuição do número de pontos de reforço na linha de sutura demonstra um o poder selante do material testado (p=0,029). Esta redução de pontos de reforço pode ter impacto no resultado e no custo, mas tal premissa não foi testada neste trabalho.
Reicher et al. [19] conseguiram reduzir o número de pontos de uma anastomose arterial com o emprego do selante de fibrina. Estes autores demonstraram diminuição da velocidade sistólica, ao Doppler e aumento de área interna da anastomose, no grupo tratado com selante. Os autores, contudo, usaram técnica cirúrgica diferente entre os grupos, criando mais de uma variável, o que dificulta uma conclusão definitiva.
Os selantes têm sido muito utilizados por seu efeito hemostático [20-23]. O sangramento per-operatório pode diminuir, como sugerem os trabalhos de Taylor et al. [20], Unlu et al. [21] e Tawes et al. [22]. Contudo, não podemos confirmar esta afirmativa com dados deste estudo. Não foi mensurada a perda sangüínea, comparando o lado controle e tratamento, por não estar previsto no protocolo inicial. A pequena quantidade de sangue perdida, após a abertura do clamp de anastomoses em artérias sadias, submetidas a suturas tecnicamente simples, desestimulou-nos a colher tal dado. Entretanto, acreditamos ser pertinente um estudo para este fim.
Sistemas de coleta de fibrina autóloga [23] podem minimizar os riscos de infecção, tornando a utilização mais segura, mas são estudos preliminares, com material ainda não disponível comercialmente na prática cirúrgica.
CONCLUSÃO
O Selante de fibrina reduziu a necessidade de pontos adicionais. Contudo, não alterou a pressão de ruptura ou o fluxo arterial, nos grupos estudados.
REFERÊNCIAS
1. Braunwald NS, Gay W, Tatooles CJ. Evaluation of crosslinked gelatin as a tissue adhesive and hemostatic agent: an experimental study. Surgery. 1966;59(6):1024-30.
2. Souza C. Uso de adesivos biológicos em anastomoses intestinais. Estudo experimental em coelhos [Tese]. Belo Horizonte:Faculdade de Medicina da UFMG;1993.
3. Schenk WG 3rd, Goldthwaite CA Jr, Burks S, Spotnitz WD. Fibrin sealant facilitates hesmostasis in arteriovenous polytetrafluoroethylene grafts for renal dialysis access. Am Surg. 2002;68(8):728-32.
4. Kheirabadi BS; Field-Ridley A, Pearson R, MacPhee M, Drohan W, Tuthill D. Comparative study of the efficacy of the common topical hemostatic agents with fibrin sealant in a rabbit aortic anastomosis. J Surg Res. 2002;106(1):99-107.
5. Kheirabadi BS, Pearson R, Tuthill D, Rudnicka K, Holcomb JB, Drohan W, et al. Comparative study of the hemostatic efficacy of a new human fibrin sealant: is an antifibrinolytic agent necessary? J Trauma. 2002;52(6):1107-15.
6. Jackson MR, Gillespie DL, Longenecker EG, Goff JM, Fiala LA, O'Donnell SD, et al. Hemostatic efficacy of fibrin sealant (human) on expanded poly-tetrafluoroethylene carotid patch angioplasty: a randomized clinical trial. J Vasc Surg. 1999;30(3):461-6.
7. Kheirabadi BS, Pearson R, Rudnicka K, Somwaru L, MacPhee M, Drohan W, et al. Development of an animal model for assessment of the hemostatic efficacy of fibrin sealant in vascular surgery. J Surg Res. 2001;100(1):84-92.
8. Giovannacci L, Eugster T, Stierli P, Hess P, Gurke L. Does fibrin glue reduce complications after femoral artery surgery? A randomized trial. Eur J Vasc Endovasc Surg. 2002;24(3):196-201.
9. Milne AA, Murphy WG, Reading SJ, Ruckley CV. A randomized trial of fibrin sealant in peripheral vascular surgery. Vox Sang. 1996;70(4):210-2.
10. Glimaker H, Bjorck CG, Hallstensson S, Ohlsen L, Westman B. Avoiding blow-out of the aortic stump by reinforcement with fibrin glue: a report of two cases. Eur J Vasc Surg. 1993;7(3):346-8.
11. Seguin JR, Picard E, Frapier JM, Chaptal PA. Repair of the aortic arch with fibrin glue in type A aortic dissection. J Card Surg. 1994;9(6):734-9.
12. Han SK, Kim SW, Kim WK. Microvascular anastomosis with minimal suture and fibrin glue: experimental and clinical study. Microsurgery. 1998;18(5):306-11.
13. Buijsrogge MP, Verlaan CW, Van Rijen MH, Grundeman PF, Borst C. Coronary end-to-side sleeve anastomosis using adhesive in off-pump bypass grafting in the pig. Ann Thorac Surg. 2002;73(5):1451-6.
14. Buijsrogge MP, Scheltes JS, Heikens M, Grundeman PF, Pistecky PV, Borst C. Sutureless coronary anastomosis with an anastomotic device and tissue adhesive in off-pump porcine coronary bypass grafting. J Thorac Cardiovasc Surg. 2002;123(4):788-94.
15. Fasol R, Schumacher B, Schlaudraff K, Hauenstein KH, Seitelberger R. Experimental use of a modified fibrin glue to induce site-directed angiogenesis from the aorta to the heart. J Thorac Cardiovasc Surg. 1994;107(6):1432-9.
16. Kawamura M, Sawafuji M, Watanabe M, Hourinouchi H, Kobayashi K. Frequency of transmission of human parvovirus B19 infection by fibrin sealant used during thoracic surgery. Ann Thorac Surg. 2002;73(4):1098-100.
17. Tabuchi N, Tanaka H, Arai H, Mizuno T, Nakahara H, Oshima N, et al. Double-patch technique for postinfarction ventricular septal perforation. Ann Thorac Surg. 2004;77(1):342-3.
18. Frost-Arner L, Spotnitz WD, Rodeheaver GT, Drake DB. Comparison of the thrombogenicity of internationally available fibrin sealants in an established microsurgical model. Plast Reconstr Surg. 2001;108(6):1655-60.
19. Reicher ME, Burihan E, Amorim JE, Nakano LCU, Barros N Jr, Egani MI, et al. Utilização da cola de fibrina em suturas vasculares: aspectos hemodinâmicos. Cir Vasc Angiol. 2001;17(6):195-201.
20. Taylor LM Jr. Introduction: Does the evidence justify the routine use of fibrin sealants in cardiovascular surgery? Cardiovasc Surg. 2003;11(Suppl 1):3-4.
21. Unlu Y, Vural U, Kocak H, Ceviz M, Becit N, Akbulut O. Comparison of the topical haemostatic agents for the prevention of suture hole bleeding: an experimental study. Eur J Vasc Endovasc Surg. 2002;23(5):441-4.
22. Tawes RL Jr, Sydorak GR, DuVall TB. Autologous fibrin glue: the last step in operative hemostasis. Am J Surg. 1994;168(2):120-2.
23. Kjaergard HK, Trumbull HR. Vivostat system autologous fibrin sealant: preliminary study in elective coronary bypass grafting. Ann Thorac Surg. 1998;66(2):482-6.







 All scientific articles published at www.bjcvs.org are licensed under a Creative Commons license
All scientific articles published at www.bjcvs.org are licensed under a Creative Commons license